- Подписи к слайдам:
- По теме: методические разработки, презентации и конспекты
- Презентация для семинара 3-го года обучения по теме «Пища» (GCSE «Forward»)
- Создание учебной презентации», презентация мастер-класса.
- Презентация на тему «Классный класс». Учащиеся 1-го класса средней школы
- Презентация на тему ‘Класс Млекопитающие’, 7 класс.
- В презентации мастер-класса: использование технологии развития критического мышления как метода на основе систематической деятельности на уроках литературы в старших классах. Техника ‘Fishbowl’.
- Презентация в программе ‘Методы визуализации, стендовый доклад’.
- Презентация на мастер-классе ‘Lynne Oilcuts’. Презентация мастер-класса ‘Lynne Oilcuts’. Этот мастер-класс был проведен для детей с особыми потребностями в Ларьякской специальной образовательной школе.
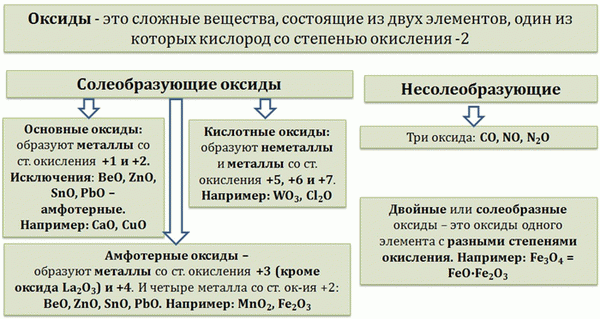
- Классификация оксидов
- Получение оксидов
- Химические свойства оксидов
- Список основных оксидов:
Подписи к слайдам:
Примеры: cao, so 2, al 2 o 3, co.
Взаимодействие простых веществ с кислородом: 2 мг + O 2 = 2 мг O 2. Горение сложных веществ на воздухе: Ch 4 + 2 O 2 = CO 2 + 2 H 2 O 3. Восстановление нерастворимых оснований: Mg(OH)2 = MGO + H 2 O 4. Восстановление некоторых кислот: H 2 SIO 3 = SIO 2 + H 2 O 5. Восстановление некоторых солей: Caco 3 =… Cao + Co 2
Это оксиды, которые не реагируют с кислотами или основаниями и не образуют солей. Оксиды образуются неметаллическими атомами: CO, NO, N 2 O. Это оксиды, которые реагируют с кислотами или основаниями с образованием солей и воды.
Это оксиды, которые реагируют как гидроксиды оснований. Например, Cuo → Cu(OH)2 Основные оксиды образуются только с металлами степеней окисления +1 и +2. Исключение составляют, например, Na 2 O, K 2 O, CaO, Mgo, Cuo, Cro. beo, zno, sno, pbo.
Взаимодействие с кислотами, образование солей и воды: MGO + HCL = MGCL 2 + H 2 O 2. Кислотные оксиды, образование солей: CaO + N 2 O 5 = Ca(no 3)2 3. Только вода (реакция только) щелочи и щелочные оксиды): Na 2 O + H 2 O = 2NAOH
Это оксиды, соответствующие кислотам как гидроксиды. Например, 3 → H 2 Таким образом, кислотные оксиды образуют все несолевые оксиды с оксидацией выше +5 и все неминералы с любой оксидацией, кроме металлов. Примеры: CO 2, N 2 O 5, SIO 2, MN 2 O 7, CRO 3.
С основаниями образуют соли и воду: CO 2 + 2KOH = K 2 CO 3 + H 2 O 2. С основаниями оксиды образуют соли: CO 2 + MGO = MGCO 3 3. С водой (большинство оксидов) образуют кислоты: SO 3 + H 2 O = H 2 SO 4 CRO 3 + H 2 O = H 2 CRO 4
Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как основания, так и кислоты. Например, Beo → Be(OH)2 → H 2 Beo 2 ZnO → Zn(OH)2 → H 2 ZnO 2 Оксиды образуются только металлами в состояниях окисления +3 и +4. Примеры: Cr 2 O 3, Fe 2 O 3, Al 2 O 3. Beo, Zno, Sno и PBO являются обоими.
Как основные оксиды. С кислотами образует соли и воду: ZnO + 2 HCl = ZnCl 2 + H 2 O 2. С кислотными оксидами образует соли: ZnO + SIO 2 = ZnSio 3 как оксидные оксиды. В щелочах образует соли и воду: ZnO + 2KOH = K 2 ZnO 2 + H 2 O 2. В основных оксидах образует соли: ZnO + CaO = Cazno 2 Амфотерные оксиды не реагируют с водой.
По мере увеличения степени окисления атомов элементов в оксиде возрастают кислотные свойства оксида и его гидроксидов. Неметаллы образуют кислотные оксиды (кроме несолевых оксидов). Металлы +1 и +2 основные оксиды окисления (кроме БеО, ЗНО, СНО, ПБО +3, +4 бескислотных оксидов, БеО, ЗНО, СНО, ПБО +5 и сильнокислотных оксидов).
По теме: методические разработки, презентации и конспекты
Презентация для семинара 3-го года обучения по теме «Пища» (GCSE «Forward»)
Эта презентация была подготовлена для проведения семинара по отдельной теме «Еда», изучаемой в классе типа «Forward» в первом полугодии 3-го года обучения. Ключевым моментом была тема ‘Let’s make pancakes!
Создание учебной презентации», презентация мастер-класса.
Визуальная поддержка мастер-класса: типичные ошибки при создании презентаций.
Презентация на тему «Классный класс». Учащиеся 1-го класса средней школы
Презентация содержит основные положения исследования по теме.
Презентация на тему ‘Класс Млекопитающие’, 7 класс.
Презентация на тему ‘Класс Млекопитающие’ 7 класс.
В презентации мастер-класса: использование технологии развития критического мышления как метода на основе систематической деятельности на уроках литературы в старших классах. Техника ‘Fishbowl’.
Презентация как методический инструмент на мастер-классах для учителей литературы в контексте обмена педагогическим опытом.
Презентация в программе ‘Методы визуализации, стендовый доклад’.
Презентация сопровождается семинаром об одном из способов упрощения процесса обучения на курсах русского языка и литературы.
Презентация на мастер-классе ‘Lynne Oilcuts’. Презентация мастер-класса ‘Lynne Oilcuts’. Этот мастер-класс был проведен для детей с особыми потребностями в Ларьякской специальной образовательной школе.
Презентация мастер-класса «Линнеевский срез масла». Мастер-класс был подготовлен и проведен для детей с ограниченными возможностями в Ларьякской терапевтической школе.
Классификация оксидов
Получение оксидов
Общие методы получения оксидов:.
1. простые взаимодействия вещества с кислородом:.
1. 1. окисление металлов: большинство металлов окисляются из оксидов с фиксированными условиями окисления.
Например, алюминий реагирует с кислородом с образованием оксидов.
Золото, платина и палладий не реагируют с кислородом.
Натрий образует в основном пероксид Na2O2,
Калий, калий и рубид образуют в основном синтетические пероксиды МпО2:
Примечание: Металлы с переменной степенью окисления обычно окисляются в промежуточной степени окисления (+3).
Железо также сгорает с образованием накипи железо — железо — железо (II, III).
1. 2 Окисление простых неметаллических веществ.
При окислении неметаллических веществ, как правило, образуются неметаллические оксиды с высшей степенью окисления, если имеется избыток кислорода или недостаток кислорода, сопровождающийся той или иной степенью окисления.
Например, оксид фосфора (V) окисляется в присутствии кислорода, оксид фосфора (V) — в присутствии кислорода фосфора (III): он окисляется при недостатке кислорода.
Однако существуют некоторые исключения.
Например, сера горит только с оксидом серы (IV).
Оксид серы (VI) получается только при окислении оксида серы (IV) в жестких условиях в присутствии катализатора.
2SO2 + O2= 2SO3
Азот окисляется кислородом только при очень высоких температурах (около 2000 o C) или под воздействием силового разряда и только с образованием оксида азота (II).
Фторид f2(фтор сам окисляется кислородом). Другие галогены (хлор хлор)2Другие галогены (хлор CL, бром и т.д.) и благородные (ад, неон, медленный, крипто) не взаимодействуют с кислородом.
2. окисление сложных веществ (бинарных соединений): например, сульфидов, гидратов, фосфоров.
При окислении кислородом сложных веществ, обычно состоящих из двух элементов, при определенных условиях окисления образуется смесь оксидов этих элементов.
Например, при сгорании пилотов ФЭС2образует оксид железа (III) и оксид серы (IV).
При сгорании водорода в присутствии избытка кислорода образуется оксид серы (IV), а в отсутствие кислорода — сера.
Аммиак, с другой стороны, горит с образованием простых веществ n2поскольку азот реагирует с кислородом только в жестких условиях: n
Однако в присутствии катализатора аммиак окисляется кислородом до оксида азота (II).
3. разложение гидроксидов. Оксиды могут также образовываться под действием гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы и самопроизвольно разлагаются на оксид и воду, которые распадаются на другие (обычно нерастворимые) гидроксиды.
Гидроксид → оксид + вода
Углекислота, серная кислота, гидроксид аммония, гидроксид серебра (I) и меди (I) самопроизвольно разлагаются в водные растворы.
2AGOH → AG2O + H2O
2cuoh → cu2O + H2O
При нагревании большинство нерастворимых гидроксидов разлагаются на оксиды — кремниевую кислоту, гидроксиды тяжелых металлов — гидроксид железа (III) и т.д.
4. Другим способом получения оксидов является расщепление сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании распадаются на оксиды.
Соли, образованные сильными окислительными кислотами (например, нитраты, сульфиты и высокие хлоры), обычно распадаются, меняя состояние окисления при нагревании: нагревание
Подробнее о расщеплении нитратов вы можете прочитать в статье: нагревание.
Химические свойства оксидов
Многие из химических свойств оксидов иллюстрируются диаграммами взаимосвязей для основных категорий неорганических веществ.
Список основных оксидов:
| Химический тип | Свойства. | Оксид кальция |
| као. | Известь, белое кристаллическое твердое вещество | Оксид магния |
| MGO | Белое вещество, слегка растворимое в воде | Оксид бария |
| Bao | Бесцветные кристаллы кубической формы | Оксид меди II |
| КУО | Черное вещество, фактически нерастворимое в воде | Оксид ртути II |
| гго | Красное или оранжево-желтое твердое вещество | Оксид калия |
| Бесцветное или бледно-желтое вещество | K2O | Оксид натрия |
| Бесцветные кристаллы | Na2O | Оксид лития |
| Вещество, состоящее из бесцветных кристаллов с кубической сетчатой структурой | Li2 O | В основных подгруппах периодической системы основные свойства оксидов увеличиваются по мере перехода от одного элемента к другому сверху вниз. |
При образовании основных оксидов кислород является одним из основных элементов. Основные оксиды имеют множество природных и химических свойств, включая взаимодействие с водой, кислотами и другими оксидами.
